04-06-2017، 20:14
(04-06-2017، 19:03)fatemeh.a* نوشته است: دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
سلام.دوستان نهمی خواهش میکنم یه نفرپیوندهای دوگانه وسه گانه روواسم توضیح بده.مرسی
پیوند دوگانه در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
شیمی ، یک دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
پیوند شیمیایی میان دو دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
عنصر است که در آن بجای آنکه یک جفت الکترون درگیر پیوند شوند، دو دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
جفت الکترون در پیوند شرکت میکنند. پیوند دوگانه در میان اتمهای دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
کربن به فراوانی دیده میشود. برای نمونه در تشکیل دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
آلکنها از این دست پیوندها استفاده شدهاست. البته گونههای فراوانی از پیوند دوگانه را میتوان در میان دو عنصر ناهمسان نیز مشاهده کرد مانند گروه دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
کربونیلها که در آن پیوند دوگانه میان اتمهای کربن و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
اکسیژن روی دادهاست. دیگر نمونههای آن عبارتند از:دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
ترکیبهای آزو (N=N)، دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
ایمینها (C=N) و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
سولفکسیدها (S=O). برای نمایش این گونه پیوندها در فرمول از دو خط موازی کوچک میان دو اتم استفاده میشود مانند علامت مساوی در ریاضی.[sup]دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
[۱] [/sup][sup]دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
[۲] [/sup]
پیوندهای دوگانه از تک دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
پیوندهای کوالانسی پایدارتر و کوتاهتر اند. دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
رتبهٔ پیوند آنها دو است.
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/3/3b/Ethylene-CRC-MW-dimensions-2D.png/150px-Ethylene-CRC-MW-dimensions-2D.png)
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/3/3b/Ethylene-CRC-MW-dimensions-2D.png/150px-Ethylene-CRC-MW-dimensions-2D.png)
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/4/4b/Acetone-CRC-MW-ED-dimensions-2D.png/180px-Acetone-CRC-MW-ED-dimensions-2D.png)
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/4/4b/Acetone-CRC-MW-ED-dimensions-2D.png/180px-Acetone-CRC-MW-ED-dimensions-2D.png)
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/b/bb/DMSO-2D-dimensions.png/150px-DMSO-2D-dimensions.png)
![[ رفع مشکلات درسی !]](https://upload.wikimedia.org/wikipedia/commons/thumb/b/bb/DMSO-2D-dimensions.png/150px-DMSO-2D-dimensions.png)
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
اتیلن
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
استون
دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
دیمتیلسولفکسید
ترکیبهای شیمیایی معمول که پیوند دوگانه دارند.
پیوند سهگانه نوعی دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
پیوند کووالانسی است که در نتیجه به اشتراک گذاشته شدن سه جفت دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
الکترون میان دو دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
اتم تشکیل میشود، یعنی بر خلاف پیوند عادی که دو الکترون ظرفیتی در آن دخیلاند، اینجا شش الکترون ظرفیتی پیوند را تشکیل میدهند. در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
کربن رایجترین پیوندهای سهگانه بین دو اتم کربن، در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
آلکینها دیده میشود.دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
سیانیدها و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
ایزوسیانیدها نیز پیوند سهگانه دارند. برخی مولکولها دواتمی مانند دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
دینیتروژن و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
کربن مونوکسید نیز پیوند سهگانه دارند. این پیوند در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
فرمول اسکلتی با سه خط افقی (≡) نمایش داده میشود.
پیوندهای سهگانه از پیوندهای عادی و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
دوگانه قویتر و کوتاهترند. دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
رتبه پیوند ۳ است.
در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
استیلن هر اتم کربن دو اوربیتال sp و دو اوربیتال p دارد. دو اوبیتال sp خطیاند و زاویهٔ ۱۸۰° دارند و محور x را در دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
دستگاه مختصات اشغال میکنند. اوربیتالهای p بر محورهای y و z عمودند. وقتی دو اتم کربن به هم نزدیک میشوند اوربیتالهای sp به اشتراک گذاشته میشوند و یک پیوند sp-sp دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
سیگما تشکیل میدهند. در همین حال اوربیتالهای p[sub]z[/sub] به هم نزدیک میشوند و دیدن لینک ها برای شما امکان پذیر نیست. لطفا ثبت نام کنید یا وارد حساب خود شوید تا بتوانید لینک ها را ببینید.
پیوند پی p[sub]z[/sub]-p[sub]z[/sub]تشکیل میدهند. جفت اوربیتال p[sub]y[/sub] دیگر نیز یک پیوند پی p[sub]y[/sub]-p[sub]y[/sub] تشکیل میدهند. درنهایت یک پیوند سیگما و دو پیوند پی تشکیل میشود.

 بازی آنلاین
بازی آنلاین آپلود عکس
آپلود عکس

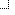





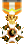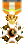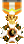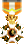


![[-] [-]](http://www.flashkhor.com/forum/images/collapse.gif)



